| نیتروژن → اکسیژن ← فلوئور |
-
↑
O
↓
S |
|
|
| ظاهر |
|---|
Colorless gas; pale blue liquid. Oxygen bubbles rise in this rotated photo of liquid oxygen.


Spectral lines of oxygen |
| ویژگیهای کلی |
|---|
| نام, نماد, عدد |
اکسیژن, O, 8 |
|---|
| تلفظ به انگلیسی |
/ˈɒksɨdʒɨn/ OK-si-jin |
|---|
| نام گروهی برای عناصر مشابه |
نافلزات, کالکوژنs |
|---|
| گروه، تناوب، بلوک |
۱۶, ۲, p |
|---|
| جرم اتمی استاندارد |
15.9994 g·mol−۱ |
|---|
| آرایش الکترونی |
1s2 2s2 2p4 |
|---|
| الکترون به لایه |
2, 6 (تصویر) |
|---|
| ویژگیهای فیزیکی |
|---|
| حالت |
گاز |
|---|
| چگالی |
(0 °C, 101.325 kPa)
1.429 g/L |
|---|
| چگالی مایع در b.p. |
1.141 g·cm−۳ |
|---|
| نقطه ذوب |
54.36 K, -218.79 °C, -361.82 °F |
|---|
| نقطه جوش |
90.20 K, -182.95 °C, -297.31 °F |
|---|
| نقطه بحرانی |
154.59 K, 5.043 MPa |
|---|
| گرمای همجوشی |
(O2) 0.444 kJ·mol−1 |
|---|
| گرمای تبخیر |
(O2) 6.82 kJ·mol−1 |
|---|
| ظرفیت گرمایی |
(O2)
29.378 J·mol−۱·K−۱ |
|---|
| فشار بخار |
|---|
| فشار (پاسکال) |
۱ |
۱۰ |
۱۰۰ |
۱k |
۱۰k |
۱۰۰k |
| دما (کلوین) |
|
|
|
61 |
73 |
90 |
|
| ویژگیهای اتمی |
|---|
| وضعیت اکسید شدن |
2, 1, −1, −2
(neutral oxide) |
|---|
| الکترونگاتیوی |
3.44 (مقیاس پاولینگ) |
|---|
انرژیهای یونیزه شدن
(more) |
1st: 1313.9 kJ·mol−1 |
|---|
| 2nd: 3388.3 kJ·mol−1 |
| 3rd: 5300.5 kJ·mol−1 |
| شعاع کووالانسی |
66±2 pm |
|---|
| شعاع واندروالانسی |
152 pm |
|---|
| متفرقه |
|---|
| ساختار کریستالی |
cubic |
|---|
| مغناطیس |
paramagnetic |
|---|
| رسانایی گرمایی |
(300 K) 26.58x10-3 W·m−1·K−1 |
|---|
| سرعت صوت |
(gas, 27 °C) 330 m/s |
|---|
| عدد کاس |
7782-44-7 |
|---|
| پایدارترین ایزوتوپها |
|---|
| مقاله اصلی ایزوتوپهای اکسیژن |
| iso | NA | نیمه عمر | DM | DE (MeV) | DP |
|---|
| 16O |
99.76% |
16O ایزوتوپ پایدار است که 8 نوترون داردs |
| 17O |
0.039% |
17O ایزوتوپ پایدار است که 9 نوترون داردs |
| 18O |
0.201% |
18O ایزوتوپ
پایدار است که 10 نوترون داردs |
|
| |

عکسی از جوزف پریستلی کاشف اکسیژن
اکسیژن (به پارسی سره: ترشمایه[نیازمند منبع]) (به فارسی افغانستان: اکسیجن) یکی از عناصر شیمیایی در جدول تناوبی است که نماد آن O و عدد اتمی آن ۸ است. یک عنصر زیستی بوده و همه جا چه در زمین و چه در کل جهان هستی یافت میشود. مولکول اکسیژن (O۲)در زمین از نظر ترمودینامیکی ناپایدار است ولی توسط عمل فتوسنتز باکتریهای بی هوازی و در مرحله بعدی توسط عمل نور ساخت گیاهان زمینی به وجود میآید.
محتویات
- ۱ ویژگیها
- ۲ کاربردها
- ۳ پیشینه
- ۴ پیدایش
- ۵ ترکیبات
- ۶ ایزوتوپها
- ۷ هشدارها
- ۸ منابع
ویژگیها
اکسیژن در دما و فشار استاندارد به صورت گاز است که حاوی دو اتم اکسیژن به فرمول شیمیایی O۲ است. اکسیژن عنصر مهم هوا است و از طریق عمل فتوسنتز گیاهان تولید شده و برای تنفس حیوانات لازم است. واژه اکسیژن در دو واژه یونانی Oxus(ترش) و Gennan (زایش) ساخته شده است یعنی چیزی که از آن ترشی پدید میآید. در فارسی میتوان برای آن واژه ترشمایه[نیازمند منبع] را بکار برد. (برابرهای زبانهای دیگر برای واژه اکسیژن مثلآ آلمانی Sauerstoff و هلندی zuurstof هم دقیقآ همین معنی ترشمایه را میدهد). اکسیژن مایع و جامد رنگ آبی کمرنگ داشته و هر دو بسیار پارامغناطیس میباشند. اکسیژن مایع معمولاً با عمل تقطیر جزئی هوای مایع به دست میآید. درصد حجمی اکسیژن 21%است
کاربردها
اکسیژن به عنوان اکساینده کاربرد بسیار زیادی داشته، وتنها فلوئور از آن الکترونگاتیوتر است. اکسیژن مایع به عنوان اکسید کننده در نیروی حرکتی موشکها استفاده میشود. از آنجا که اکسیژن برای تنفس ضروری است در پزشکی کاربرد دارد. گاهی اوقات کسانی که کوه نوردی میکنند یا در هواپیما پرواز میکنند، مخازن اکسیژن همراه دارند (به عنوان هوا). اکسیژن در جوشکاری و ساخت فولاد و همچنین متانول نیز کاربرد دارد.
اکسیژن به عنوان یک ماده آرامش بخش، سابقه کاربرد دارد که تا زمان حال نیز ادامه دارد و بارهای اکسیژن در مهمانیها و بزمهای امروزی وجود دارد. در سده ۱۹ اکسیژن معمولاً با اکسید نیترات ترکیب میشد که اثر تسکین دهنده دارد.
پیشینه
اکسیژن در سال 1771 از سوی داروساز سوئدی کارل ویلهلم شیله کشف شد، ولی این کشف خیلی سریع شناخته نشد و با اکتشاف مستقل جوزف پریستلی به طور گسترده تری شناخته شد، و از سوی آنتوان لورن لاووزیه در سال ۱۷۷۴ نامگذاری شد.
پیدایش
اکسیژن فراوانترین عنصر در پوسته کره زمین است و برآوردهایی در این زمینه وجود دارد که مقدار آن را ۴۶٫۷% ذکر میکنند. اکسیژن ۸۷% اقیانوسها (به صورت آب ،H۲O)و ۲۰% درصد جو زمین (به صورت اکسیژن مولکولی، O۲، یا O۳، ازن) را به خود اختصاص میدهد. ترکیبات اکسیژن بویژه اکسید فلزات و سیلیکاتها (SiO۴۴-) و کربناتها
(CO۳۲-)معمولاً در خاک و تخته سنگها یافت میشوند. آب یخ زده یک جسم سخت متداول بر روی سیارات دیگر و ستارههای دنباله دار میباشد. کلاهکهای یخ کره مریخ از دی اکسید کربن منجمد تولید شده اند. ترکیبات اکسیژن در سراسر کهکشان یافت میشوند و طیف نور اکسیژن اغلب در ستارهها دیده میشود.
ترکیبات
الکترون به خاطر وجود الکترونگاتیویتی، اکسیژن تقریباً با تمام عناصر دیگر پیوند شیمیایی تشکیل میدهد(که این مطلب منشا تعریف اصلی اکسید شدن میباشد). تنها عناصری که تحت عمل اکسایش قرار نمیگیرند گازهای اصیل هستند. یکی از معروفترین این اکسیدها اکسید هیدروژن یا آب است H۲O. سایر اکسیدهای معروف دیگر ترکیبات کربن و اکسیژن هستند مانند دی اکسید کربن (CO۲)، الکلها (R-OH)، آلدئیدها (R-CHO) و کربوکسیلیک اسیدها (R-COOH). رادیکالهای اکسیژن مانند کلراتها
(ClO۳-)، پرکلراتها (ClO۴-)، کروماتها (CrO۴۲-)، دی کروماتها (Cr۲O۷۲-)، پرمنگناتها (MnO۴-)، و نیتراتها (NO۳-)، اکسایندههای قوی هستند. خیلی از فلزات مانند آهن با اتم اکسیژن پیوند برقرار میکنند اکسید آهن(Fe۲O۳).ازن (O۳)، با عمل تخلیه برق ایستایی (الکترواستاتیکی) در حضور مولکول اکسیژن شکل میگیرد. ملوکول اکسیژن دوتائی (O۲)۲ نیز شناخته شده، که از جزء کمی از اکسیژن مایع را تشکیل میدهد. اپوکسیدها و اترها موادی هستند که در آن اتم اکسیژن قسمتی از یک حلقه سه اتمی هستند.
ایزوتوپها
اکسیژن طبیعی مخلوطی از سه ایزوتوپ پایدار هست: اکسیژن-16 (99.759 درصد)، اکسیژن-17 (0.037 درصد) و اکسیژن-18 (0.204 درصد). اکسیژن ده ایزوتوپ پرتوزا نیز دارد. ایزوتوپهای پرتوزایی همه، نیمه عمری کمتر از سه دقیقه دارند. بیشترین نیمه عمر را اکسیژن-15 (124 ثانیه) دارد که در بررسی تنفس پستانداران استفاده می شود.
هشدارها
اکسیژن در فشارهای نسبی بالا میتواند سمی باشد.
قرارگرفتن طولانی در معرض اکسیژن خالص میتواند برای شش و سامانه عصبی سمی باشد. تأثیرات ریوی شامل آماس شش (ورم ریه) کاهش ظرفیت شش و آسیب به بافتهای ششی میباشد. تأثیرات بر سامانه عصبی شامل کاهش بینایی، تشنج و اغما میشود.
همچنین مشتقات خاصی از اکسیژن، مانند ازون (O۳)، پروکسید هیدوژن و رادیکالهای هیدروکسیل و سواکسیدها بسیار سمی میباشند. بدن سازوکارهایی را برای مقابله با این گونهها توسعه داده. برای نمونه، عامل طبیعی گلوتاتیون (glutathione) و بیلی روبین که فراورده بخش شدن طبیعی هموگلوبین است، میتوانند به عنوان یک پاداکسید (ضد اکسید) عمل کنند. منابع تمرکزیافته اکسیژن باعث احتراق سریع شده و بنابراین، در کنار فراوردههای سوختی خطر گسترش سریع آتش سوزی و انفجار وجود دارد.
آتشی که در مخازن اکسیژن آپولو ۱۳ رخ داد به این دلیل سریع گسترش پیدا کرد، که فشار جوی اکسیژن در حالت معمولی بود[نیازمند منبع]، در حالی که هنگام عملیات پرتاب این فشار باید یک سوم فشار جوی معمولی باشد. (ببینید فشار نسبی را).
منابع
- آزمایشگاه ملی لوس آلاموس - اکسیژن
- [oxygen. (2009). Encyclopædia Britannica. Ultimate Reference Suite. Chicago: Encyclopædia Britannica]
<td
| [نهفتن]
جدول تناوبی |
|---|
| H |
|
He |
| Li |
Be |
|
B |
C |
N |
O |
F |
Ne |
| Na |
Mg |
|
Al |
Si |
P |
S |
Cl |
Ar |
| K |
Ca |
|
Sc |
Ti |
V |
Cr |
Mn |
Fe |
Co |
Ni |
Cu |
Zn |
Ga |
Ge |
As |
Se |
Br |
Kr |
| Rb |
Sr |
|
Y |
Zr |
Nb |
Mo |
Tc |
Ru |
Rh |
Pd |
Ag |
Cd |
In |
Sn |
Sb |
Te |
I |
Xe |
| Cs |
Ba |
تاریخ : شنبه 12 بهمن 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
موریانه ها،قهرمان ساخت و ساز اند .آنها نوعی لانه ی گلی می سازند که
به طور معمول چهار برابر ق یک آدم است!
در این لانه ها در کم ترین صورت5000000موریانه توانایی زندگی دارد!!!

تاریخ : شنبه 12 بهمن 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
سوسک استوایی سریع ترین حشره ی دونده ی دنیا است
سرعت حرکت این حشره به 5 کیلومتر در ساعت می رسد!
تاریخ : شنبه 12 بهمن 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
حشره ی ترکه شکل غول پیکر اندونزی
بزرگترین حشره ی دنیا است.این حشره 33 سانتی متر طول دارد
یعنی تقریبا به اندازه ی یک برگ a4

تاریخ : چهار شنبه 2 بهمن 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
تاریخچه میکروسکوپ

در روزگاران قدیم، كوچكترین موجودات زنده ای كه مردم می شناختند آن هایی بودند كه به زحمت با چشم دیده می شدند. ولی آیا ممكن بود موجوداتی هم باشند كه با چشم دیده نشوند؟ اگر با چشم دیده نمی شدند، با چه وسیله ای ممكن بود آن ها را دید؟ البته در آن زمان هم مردم با وسایلی می توانستند كاری كنند كه ذرات خیلی كوچك، بزرگتر از آنچه بودند نشان داده شوند. مثلاً بعضی از مردم متوجه شده بودند كه اگر از میان شیشه ای كه سطح آن منحنی باشد به ذرات خیلی كوچك نگاه كنند، آن ها بزرگتر از آنچه هستند به نظر می آیند.
در حدود سال 1650 میلادی دانشمندان با این شیشه های منحنی به چیز های خیلی كوچك نگاه كردند و به دقت به بررسی آن ها پرداختند. اسم این شیشه ها را، كه سطح منحنی داشتند، عدسی گذاشتند. زیرا شكل آن ها مثل دانه های عدس بود. معمولاً برای اینكه به چیز های بسیار كوچك نگاه كنند، بیش از یك عدسی به كار می بردند و عدسی ها را در دو انتهای یك لوله ی فلزی جا می دادند. اسم ین لوله را، با عدسی هایی كه درون آن بود، میكروسكوپ گذاشتند.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
سوسک قورباغه خور

عادت غذایی سوسکهای کوچکی به نام "اپومیز" برای بسیاری از دوزیستان از قبیل قورباغه ها بسیار وحشتناک و دردآور است زیرا این سوسک با حضور در کنار دوزیستان اعتماد آنها را جلب کرده و سپس آنها را به قتل می رساند.
یکی از انواع سوسکهای زمینی عادت غذایی بسیار ترسناک و عجیبی دارد. این سوسک که "اپومیز" نام دارد بسیاری از دو زیستان که ابعاد بدن آنها چند برابر ابعاد بدن خودش است را کشته و می خورد، در حالی که معمولا دوزیستان از حشرات تغذیه می کنند نه حشرات از دو زیستان!
غذای معمول این سوسکها دیگر انواع بی مهرگان از قبیل پشه ها، کرمها و حشرات مرده است اما محققان در نهایت ناباوری مشاهده کردند هر زمان این سوسک در کنار یک دو زیست مانند قورباغه قرار می گیرد به راحتی آن را کشته و می خورد.
این سوسکها ترجیح می دهند پیش از شکار کردن یک دوزیست به خوبی شکار خود را شناسایی کنند از این رو در طول روز با به اشتراک گذاشتن پناهگاهشان با دوزیستان در نزدیکی آنها زندگی می کنند اما در شب همه چیز مرگبار شده و سوسک با حمله ای ناگهانی دوزیست را می کشد.
این سوسکها برای تامین غذای خود چندان وسواس به خرج نمی دهند و همه انواع دوزیستان را می خورند، از قورباغه ها گرفته تا وزغ، سمندر آبی و مارمولک.
نحوه به قتل رسیدن دوزیستان به این شکل است که سوسک ابتدا پشت دو زیست را می گزد که در نتیجه آن شکار از خود عکس العمل شدیدی نشان می دهد و تلاش می کند سوسک را به گوشه ای پرتاب کند.
سپس سوسک در پشت دو زیست شکافی به وجود می آورد که جاندار را طی چند دقیقه فلج می کند و در نهایت سوسک به آرامی خوردن غذایش را آغاز می کند.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
چگونگی بقای مورچهها در برابر سیل

چگونگی بقای مورچهها در برابر سیل
اسرار چگونگی زنده ماندن مورچههای آتشین در برابر سیل که برای چندین دهه زیستشناسان را سردرگم ساخته بود، اکنون توسط دانشمندان و مهندسان آمریکایی حل شده است.
محققان موسسه فناوری جورجیا از مدلسازی ریاضیاتی و تصویربرداری زمانگریز برای نمایش اینکه چگونه مورچهها در زمان سیل بخشهای مختلف بدن خود مانند چنگالها و آروارهشان را برای ساخت نوعی قایق به هم متصل کرده تا برای چند روز روی آب شناور بمانند، استفاده کردهاند.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
چرا جغدها میتوانند سر خود را بچرخانند؟!
جغدها علاوه بر انعطافپذیری بالای بافت و مهرههای گردنی خود برای اینکه بتوانند سر را به سادگی بچرخانند، شریان پشتیبانی دارند که در هنگام گردش سریع سر، مواد مغذی و اکسیژن مورد نیاز آنرا تأمین میکند.
جغدها بر خلاف ما انسانها و بسیاری دیگر از گونههای جانوری میتوانند بدون اینکه کوچکترین آسیبی به اسکلت و رگهای خونی گردن خود وارد کنند، سر را حداکثر 270 درجه بچرخانند. فکر میکنند این انعطافپذیری حیرتانگیز چطور به وجود آمده است؟
به گزارش نشنال جئوگرافیک، محققان دانشکده پزشکی دانشگاه جانز هاپکینز موفق شدهاند راز این توانایی جادویی جغدها را فاش کنند.
آنها میگویند مهرههای گردنی و رگهای خونی این پرنده برای گردش سریع سر طراحی شده است.
 ینجاست که جغدها مانند ما انسانها و بسیاری از گونههای دیگر نمیتوانند چشمهای خود را حرکت بدهند و در حقیقت چرخش سر جای حرکت چشم آنها را برای دیدن
ینجاست که جغدها مانند ما انسانها و بسیاری از گونههای دیگر نمیتوانند چشمهای خود را حرکت بدهند و در حقیقت چرخش سر جای حرکت چشم آنها را برای دیدن

تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
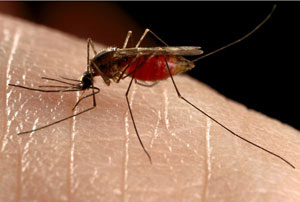
چرا پشه بعضیها را بیشتر نیش میزند؟
شما هم می دانید که پشه ها بیشتر جذب برخی افراد می شوند و به نظر می رسد قسمت هایی از بدن را بیشتر دوست دارند، اما آیا می دانید چرا این گونه است؟ این موضوع یکی از وسیع ترین تحقیقات در سال های اخیر بوده است.
بر طبق تحقیقات، هر نوع پشه، به یک چیز جذب می شود، برای مثال برخی پشه ها ممکن است جذب خون انسان شوند، در حالی که برخی دیگر تنها جذب خون حیوانات می شوند.
در متن زیر برخی از مواردی که پشه ها را جذب می کنند، نام می بریم:
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی

شرکتی مکانیکی با پشتیبانی وزارت دفاع آمریکا نوعی هواپیما ابداع کرده است که می تواند مشابه مرغ مگس خوار ، برای پرواز بال هایش را به هم بزند.
محققان نوعی هواپیمای کوچک و 19 گرمی ابداع کرده اند که با استفاده از باله های متحرکش می تواند با سرعت بالایی پرواز کرده و در میان آسمان مانور دهد و به واسطه ثبت عکس های هوایی اطلاعات محیطی مختلفی را در اختیار کاربرانش قرار دهد.
این هواپیما که مشابه مرغ های مگس خوار می تواند بال هایش را با سرعت به هم بزند NAV نام داشته و توسط شرکتی به نام «ارووایرمنت» و تحت قرارداد این شرکت با وزارت دفاع آمریکا ساخته شده است. در یک نمایش آزمایشی این مرغ مگس خوار مکانیکی توانست از فضای خارج وارد یک ساختمان شده و پیش از خروج از ساختمان تصاویر اکتشافی متعددی را به ثبت برساند.
مرغ مگس خوار مکانیکی می تواند با استفاده از باطری داخلی اش برای هشت دقیقه پرواز کند. همچنین با کمک شبیه سازی ساختارهای واقعی بدن مرغ مگس خوار این هواپیما از کارایی بسیار بالایی برخوردار بوده و با کمک بال هایی که می تواند مانند پرنده ها آنها را به هم بزند، پروازی کارامدتر از پرواز با استفاده از موتورها و یا ملخ های هواپیما دارد.
بدنه این هواپیما نیز مشابه بدن مرغ مگس خوار طراحی شده با این تفاوت که بال های هواپیما بلند تر از بال های پرنده واقعی بوده و در عین حال به جای پا و دم برای این هواپیما از میله هایی برای فرود آمدن استفاده شده است.
طول بال این نمونه دست ساز 16 سانتیمتر بوده و می تواند با سرعتی برابر 17 کیلومتر بر ساعت پرواز کند. همچنین این هواپیما می تواند در برابر وزش بادی به قدرت 8 کیلومتر بر ساعت مقاومت کند.
مرکز تحقیقات وزارت دفاع آمریکا، در نظر دارد برای بهبود دادن توانایی های این مرغ مگسخوار مکانیکی، سیستم GPS و سیستم خودکار ممانعت از برخورد با موانع را به آن افزوده و سیستم ارتباطاتی و انرژی آن را بهبود دهد.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی

زمانی که پای مد در میان باشد، لباس هیچ حیوانی چون گوره خر منحصر به فرد نیست. راههای نقش بسته بر بدن هر گوره خر، مانند اثر انگشت، کاملا منحصر به همان گوره خر هستند و هیچ نمونه مشابهی ندارند. از آن جالب تر اینکه به طور کلی سه گونه گوره خر در تمام جهان وجود دارد که الگوی کلی خط های بدن هر یک از آنها با گونه دیگر متفاوت است.
اما چرا گورخر ها خط دارند؟ دانشمندان هنوز نتوانسته اند به این پرسش پاسخ دهند، اما برخی معتقدند خطوط موجود بر تن گورخرها به نوعی به استتار آنها در مقابل شکارچیان کمک میکند. وجود این خطوط موجب میشود حیوانات شکارچی نتوانند یک حیوان منفرد را از گله ای در حال حرکت متمایز کند.
همچنین این خطوط مانع از حمله حشراتی میشوند که حیوانات را تنها از راه دیدن سطوح وسیعی یک رنگ تشخیص میدهند. همچنین تفاوتهای خطوط نقش بسته بر بدن هر گوره خر نسبت به گوره خرهای دیگر به آنها در شناسایی هم کمک میکند.
گوره خرها حیوانات اجتماعی هستند که در چمنزارها زندگی میکنند. آنها با یکدیگر به چرا میروند و حتی در تیمار کردن هم به یکدیگر کمک میکنند.
گونه بورچل گوره خرها، بیشترین جمعیت از این نوع جانور را به خود اختصاص داده است. این حیوانات در گروههای خانوادگی کوچکی متشکل از یک مرد، چندین زن و فرزندانشان زندگی میکنند. این خانوادهها میتوانند با هم همراه شده و گلههایی بزرگ را تشکیل دهند. با این حال در گلههای بزرگ نیز روابط خانوادگی گوره خرها حرف اول را میزند.
گوره خرها همواره باید نسبت به حمله شیرها هشیار باشند. در صورتی که یک گوره خر مورد حمله حیوانی وحشی قرار بگیرد دیگر اعضای خانواده او با حلقه زدن به دورش از وی دفاع میکنند تا شاید بتوانند شکارچی را از محل فراری دهند.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
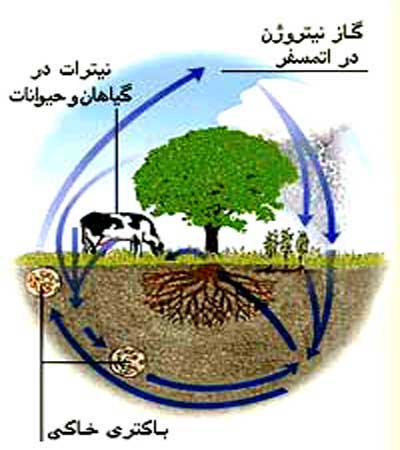
حدود 78 درصد از جوّ زمین را نیتروژن تشکیل داده است. مقدار معینی از این نیتروژن، به طور مداوم از جوّ گرفته و به آن بازپس داده می شود. به گردش مداوم نیتروژن بین خاک، آب، هوا و موجودات زنده «چرخه ی نیتروژن» می گویند. تمام موجودات زنده برای ادامه ی حیات به نیتروژن احتیاج دارند. در واقع نیتروژن یکی از اجزای تشکیل دهنده ی پروتئینها و اسیدهای نوکلئیک است که وجود هر دو برای ادامه ی حیات ضروری است.
قسمتی از نیتروژن موجود در هوا هنگام رعد و برق از آن جدا می شود. تخلیه ی ناگهانی بار الکتریکی باعث می شود مقداری از اکسیژن و نیتروژن موجود در هوا با هم ترکیب شوند و اکسیدهای نیتروژن به وجود آید. اکسیدهای نیتروژن پس از حل شدن در آب با سایر عناصر ترکیب می شوند و ترکیبات نیتروژن دار تولید می کنند.
برخی از باکتریها و جلبکها نیز نیتروژن موجود در هوا را جذب می کنند. باکتریهای خاصیّ که در ریشه ی برخی از گیاهان مثل نخود، لوبیا، نخودفرنگی و غیره وجود دارند، نیتروژن هوا را به طور مستقیم جذب می کنند و در اختیار گیاه قرار می دهند.
گیاهان با استفاده از نیتروژن، پروتئین می سازند و جانوران با خوردن گیاهان، این پروتئینها را وارد بدن خود می کنند.
گیاهان و جانوران پس از مرگ توسط تجزیه کنندگان موجود در خاک تجزیه می شوند. به این ترتیب ترکیبات نیتروژن دار وارد خاک شده، توسط گیاهان مصرف می شوند. جانوران، ترکیبات نیتروژن دار را با خوردن گیاهان یا سایر جانوران گیاهخوار وارد بدن خود می کنند.
باکتریهای تجزیه کننده ی موجود در خاک مقداری از ترکیبات نیتروژن دار خاک را به نیتروژن گازی شکل تبدیل می کنند. به این ترتیب تقریباً همان اندازه نیتروژنی که از هوا گرفته و مصرف می شود، مجدداً به آن باز می گردد.
در واقع نیتروژن موجود در هوا از خاک، اندامهای مختلف گیاهان و بدن جانوران عبور می کند و در نهایت دوباره هوا می شود. این کار ممکن است هزاران و یا حتّی میلیونها سال طول بکشد؛ ولی هر مولکول نیتروژن سرانجام به هوا باز می گردد.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
همه ما برای بیدار شدن در هنگام صبح احتیاج به كمك داریم. برای بعضیها صدای بلند زنگ ساعت میتواند مفید باشد و بعضی دیگر هم تا یك فنجان بزرگ چای یا فهوه غلیظ ننوشند نمیتوانند خود را از بستر گرم و نرم رختخواب رها كنند. حدود 62 درصد از مردم بین 15 دقیقه تا یك ساعت زمان احتیاج دارند تا به طور كامل هوشیاری خود را به دست بیاورند و آماده انجام كارهای روزانه خود شوند. اما چرا اینگونه است؟ تعدادی از متخصصان علوم خواب به این سوال پاسخ دادهاند.
چرا برای تعدادی از مردم بیدار شدن از خواب سختترین كار جهان است؟
چرا سخت است از رختخواب بیرون بیایم؟
اگر هنگام صبح با سختی از خواب بیدار میشوید و با تمام وجود آرزو میكنید كه كاش یك ساعت دیگر را میتوانستید در تختخواب خود سپری كنید، باید به دنبال دو دلیل اصلی باشید:
1- به احتمال بسیار زیاد شما دچار كمبود خواب هستید و در طول شب گذشته كمتر از میزان توصیه شده توسط كارشناسان یعنی بین هفت تا هشت ساعت خوابیدهاید.
2- شاید هم این موضوع ناشی از بههمخوردن ریتم طبیعی بدن شما باشد.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی

چگونه برخی پستانداران نفس خود را 90 دقیقه نگه میدارند؟
زیستشناسان دانشگاه لیورپول توانستهاند دلیل اینکه چگونه پستاندارانی مانند نهنگ عنبر که شیرجههای عمیق میزنند، میتوانند نفس خود را بیش از یک ساعت حبس کنند را پیدا کردهاند.
به گفته دانشمندان این توانایی از آنجا نشات میگیرد که این پستانداران از پروتئین های باردار الکتریکی در خون خود برخوردارند.
به باور محققان، این نتایج ممکن است بتواند دلیل اینکه چرا این حیوانات میتوانند نفس خود را برای بیش از یک ساعت حبس کنند در حالیکه سایر پستانداران تنها قادر به انجام این کار برای چند دقیقه هستند را توضیح دهد.
نهنگهای عنبر برخی از طولانیترین شیرجهها را در میان پستانداران دارند که برخی از آنها 90 دقیقه نیز طول میکشد. این در حالیست که دلفینها و سایر نهنگها تنها برای 20 دقیقه میتوانند زیر آب بمانند.طولانیترین زمانی که یک انسان توانسته نفس خود را در زیر آب حبس کند 19 دقیقه بوده که توسط پیتر کولات، قهرمان شیرجه آزاد سوئیسی ثبت شده است.
این محققان یک نشانه مولکولی خاص پروتئینی موسوم به میوگلوبین را که اکسیژن را وارد خون میکند، در 100 گونه متفاوت پستاندار بررسی کردند.
آنها دریافتند که در موجوداتی که شیرجههای عمیق میزنند، این پروتئین از بار الکتریکی بیشتری برخوردار میشود.این بار باعث دفع پروتئینها توسط یکدیگر شده که از شکلگیری تودهها برای انتقال اکسیژن جلوگیری میکند.
به گفته دانشمندان، این بدان معنی است که نهنگهای عنبر میتوانند میوگلوبین بیشتری را در ماهیچههای خود نگهدارند بدون اینکه به عملکرد آنها تاثیر بگذارد.میوگلوبین معمولا رنگ قرمز گوشت را تامین کرده و در تراکمهای بسیار بالا در ماهیچههای پستاندارانی که در اعماق دریا شکار میکنند، دیده شدهاند. این امر باعث تیره و سیاه بودن رنگ ماهیچههای آنها شده است.
این پژوهش در مجله ساینس منتشر شده میتواند همچنین به ارتقای درک بیماریهای انسان مانند آلزایمر که در آنها پروتئینها به یکدیگر میچسبند، کمک کند. از دیگر کاربردهای آن میتواند کمک به تولید جایگزینهای مصنوعی خون باشد.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی

آیا در باره جنگلی که نیمی از روز را روی آب است و نیمی دیگر را در زیر آبهای گرم میخوابد چیزی شنیدهای؟
به بندر «لافت» میرسم؛ بندری در شمال غربی جزیره قشم. ساعت 6 صبح است.
تا آن دور دستها، تا جایی که چشم کار میکند، چیزی جز آبهای آرام خلیج فارس نمیبینی. ساعتی میمانی، صبر میکنی. طولی نمیکشد جابهجا روی آب لکههای تیرهای میبینی. لکههایی بیشتر و بیشتر که کمکم به شاخههای سرسبز درختانی انبوه تبدیل میشود. آرام و قرار نداریم. وسوسه دیدن جنگل «حرا» ما را به سمت قایق و راهنمای محلی میکشاند. حالا دیگر با کمال تعجب، جزیرههای بزرگی را رو به روی خود میبینیم که بستر لجنیشان را جنگلی انبوه فرا گرفته است و جیغ و داد انواع پرندهها بر بالای جزیره دمی خاموش نمیشود.

اولین بار ابوعلیسینا، دانشمند بزرگ ایرانی، درخت این جنگل را حرا نامیده است. درخت حرا درخت خاصی است و در جاهایی میروید که هنگام مد دریا، به زیر آب میرود. ریشه این درختان هوایی، اسفنجی و زانویی است. هنگامی که بر سطح جنگل پا میگذاریم، کف جنگل پر از تیغهایی است که از زمین بیرون زدهاند.
این تیغها همان ریشههای درختان هستند که به شیوه منحصر به فردی، آب شور دریا را به آب شیرین تبدیل میکنند. درختان حرا در اواخر تیرماه و اواسط مرداد ماه به گل مینشینند و میوه میدهند. گل آنها زرد روشن است و میوهشان شیرین و گوارا. میوه بادامی شکل این درختان پس از مدتی بر روی پایه مادری میشکفد و دانه آن جوانه میزند و سپس داخل آب میافتد. جریان شدید امواج، بذر گیاه را به قسمتهای کم تحرکتر دریا میبرد. سپس بذر حرا بر روی لایههای خاک دریا تثبیت میشود و رشد و نمو میکند.
ارتفاع درختان حرا گاهی به 4 متر و قطر تنه آن تا 30 سانتی متر میرسد.
براساس آزمایشهای انجام شده، برگ درخت حرا علاوه بر خوشخوراک بودن برای دامها، ارزش غذایی معادل جو و یونجه دارد و البته میزان پروتئین آن هم بسیار زیاد است، به همین جهت دامداران سنتی جزیره قشم، از برگ این درختان برای تغذیه چارپایان خود استفاده میکنند.
این جنگلها به دلیل مساعد بودن شرایط زیست محیطیشان، زیستگاه بسیاری از پرندگان مهاجر و نادری است که در فصلهای سرد سال به آن پناه میآورند.

در سایر فصلها نیز که پرندگان بومی، محل مناسبی برای زندگی نمییابند، به این جنگلها پناه میآورند. غیر از پرندگان آبزی و مهاجر، خزندگان و ماهیها و حتی برخی از بندپایان و دو کفهایها هم در میان این جنگلها دیده شدهاند. در ضمن، لاکپشتهای سبز و عقابی، مارهای دریایی سیاه، حواصیل بزرگ هندی، حواصیل سبز و خاکستری، فلامینگو، پلیکان، عقاب ماهیگیر، کفچه نوک، کاکایی و انواع دیگر پرندگان نیز در این جزیره زندگی میکنند.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی

چرا حشرات یخ نمی زنند
آیا تا به حال حشره ای را دیده اید که در سرما لباس زمستانی به تن کرده باشد؟ بی شک هیچ حشره ای را ندیده اید که برای در امان ماندن از سرمای زمستان، لباسی از جنس پوست حیوانات به تن داشته باشد.
این در حالی است که این موجودات خونسرد هستند و دمای بدن آنها نزدیک به دمای محیط اطرافشان است. به نظر شما چرا این موجودات در سرما یخ نمی زنند؟ چه عاملی به آنها کمک می کند بتوانند در مقابل سرمای هوا از خود مقاومت نشان داده و به حیاتشان ادامه دهند؟
البته بعضی از حشرات در اثر سرما می میرند. بسیاری از گونه های حشرات تنها در یک مرحله زندگی، خود را با سرمای زمستانی تطبیق می دهند.
برای مثال در بعضی از حشرات تنها آنها که در مرحله شفیرگی هستند و بدنشان داخل پیله ای عایق قرار گرفته است توانایی مقاومت در برابر سرمای هوا را دارند.
حشرات دیگر مانند پشه ها و ملخ ها اصلا در برابر سرما مقاوم نبوده و بسرعت می میرند. اما این حشرات در اعماق آب یا خاک تخمگذاری می کنند تا تخم ها در سرمای هوا یخ نزند تا زمانی که تخم ها در این شرایط از سرمای هوا مصون بمانند، می توانند در آغاز فصل بهار سر از تخم بیرون بیاورند.
اما برخی از حشرات بالغ و عنکبوت ها در سرمای هوا زنده می مانند و کاهش دمای هوا تهدیدی علیه حیات این گروه از موجودات نیست.
این گروه از حشرات در اعماق زمین که در مقایسه با سطح زمین دمای بیشتری دارد مخفی می شوند و در خانه های گرمی که در دل خاک می سازند پناه می گیرند.
یکی از قابلیت های حشرات این است که گروهی از آنها با آغاز فصل سرما به خواب زمستانی می روند و با این روش خود را از سرمای زمستان مصون نگه می دارند.
اما هنوز محققان درباره خواب زمستانی حشرات به یافته هایی دست نیافته اند و از این رو به نظر می رسد خواب زمستانی حشرات در مقایسه با دیگر موجوداتی که در زمستان به خواب می روند متفاوت باشد.
اما آنچه مسلم است حشراتی که به خواب زمستانی می روند به طور کامل غیرفعال شده و کاهش متابولیسم بدن در این موجودات به آنها این امکان را می دهد تا بتوانند در سرمای زمستان از ذخیره چربی بدنشان برای زنده ماندن استفاده کنند.
بسیاری از حشراتی که به خواب زمستانی می روند، حتی در دمای کمتر از نقطه انجماد نیز می توانند زنده بمانند. به نظر شما چنین چیزی چطور ممکن است؟ این موجودات نوعی ضدیخ انحصاری در بدنشان می سازند.
هنگام خواب زمستانی، حشرات انواع مختلفی الکل در بدنشان تولید می کنند. این الکل، نقطه انجماد مایعاتی که در بدنشان وجود دارد را به میزان قابل توجهی کاهش می دهد.
این ضدیخ طبیعی به بسیاری از حشرات کمک می کند در سرمای زمستان زنده مانده و با آغاز فصل بهار زندگی را دوباره از سر گیرند.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
تفاوت IQ و EQ افراد در چیست؟
تقریباً همه افراد واژه IQ یا ضریب هوشی را شنیدهاند و كم و بیش با مفهوم آن آشنا هستند.
اما آنچه كمی ناشناخته باقی مانده و هنوز گروه زیادی با آن غریبه هستند، EQ یا همان هوش هیجانی است؛ همان چیزی كه براساس نظر دانشمندان میتواند عاملی برای موفقیت افراد باشد، همان چیزی كه میتواند برای كنترل استرس و اضطراب به فرد كمك كند و همان چیزی كه موجب میشود افراد در جامعه موفقتر عمل كنند.
سالهای سال دانشمندان تصور میكردند IQ تنها عاملی است كه میتواند موفقیت افراد را تعیین و آن را تضمین كند، در حالی كه امروزه نظر آنها تغییر كرده و میگویند EQ هم عاملی بسیار مهم برای موفق بودن یا نبودن افراد مختلف است.
البته براساس نظریاتی كه امروزه مطرح میشود، EQ حتی مهمتر از IQ نیز به حساب میآید، به این معنا كه EQ تعریف گستردهتری دارد و IQ تنها بخش كوچكی از آن است.
خلاقیت، ارتباط مناسب با دیگران، استفاده از حواس پنجگانه و تجربیات مناسب از حواس همگی در محدوده هوشهیجانی، هوشعاطفی یا همان هوشاحساسی جای میگیرد البته باید بدانید هوشهیجانی قابلیت رشد و پرورش هم دارد و هرچه بهتر و موفقتر بتوانیم آن را مدیریت كنیم و هوشهیجانی را در خودمان و فرزندانمان بیشتر پرورش دهیم، تاثیرات مثبتی هم از آن در زندگیمان مشاهده خواهیم كرد.
برای اینكه بهتر متوجه این موضوع شوید، به این مثال توجه كنید: امنیت شغلی یكی از موضوعات مهم و یكی از بزرگترین دغدغههای انسان امروزی است،اما فردی كه EQ بالایی دارد و براحتی میتواند با دیگران ارتباطات مناسبی برقرار كند، به طور حتم امنیت شغلی بهتر و بیشتری هم خواهد داشت البته مبحث EQ فقط به این موضوع ختم نمیشود و تعریفهای گستردهتری دارد؛ رضایتمندی از زندگی زناشویی، داشتن روابط اجتماعی لذتبخش، ارتباط شغلی مناسب، انگیزش شغلی و ارتباط مناسب والدین با فرزندان همگی از جمله مواردی است كه در صورت استفاده مناسب از هوشهیجانی میتواند رشد كند و بهبود یابد.
در واقع، هوشهیجانی بیشتر بر موضوع ارتباط مناسب افراد با یكدیگر تاكید میكند كه متأسفانه در این دوران كمی به دست فراموشی سپرده شده است.
در صورتی كه اگر به این موضوع اهمیت بیشتری بدهیم، تاثیر مثبتی بر خود بویژه فرزندانمان خواهیم گذاشت كه به این ترتیب در پرورش هوشهیجانی آنها نیز موثر خواهیم بود.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
گربهها اجسام را چگونه میبينند؟
دید در گربهها :
کیفیت دید در گربهها از ديد سگها بسیار ضعیفتر است ، به طوری که تصاویر را به نوعی سیاه و سفید مشاهده میکنند.
تحقیقات نشان داده است که گربهها تقریبا فقط دارای گیرندههای استوانهای هستند. تیز بینی گربهها - با این که فووا ندارند - از ما بیشتر است ، که دلیل این امر متراکمتر بودن گیرندههای نوری استوانهای آنها نسبت به انسانهاست.
ديدن اجسام از ديد انسان و گربه در روز

گربهها در شب دارای توانایی دید بهتری هستند؛ زیرا دارای گیرندههای نوری استوانهای فراوانی میباشند (شکل زیر را ببینید).
ديدن اجسام از ديد انسان و گربه در شب

گربهها توانایی دیدن اجسام متحرک را بیشتر از ما دارند و محدوده دیدشان تقریبا مشابه ماست. محدوده دید دو چشمی و وسعت دیدشان نیز مشابه انسان میباشد.
گربهها در تاریکی مطلق توانایی دیدن ندارند.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
سگها اجسام را چگونه میبينند؟
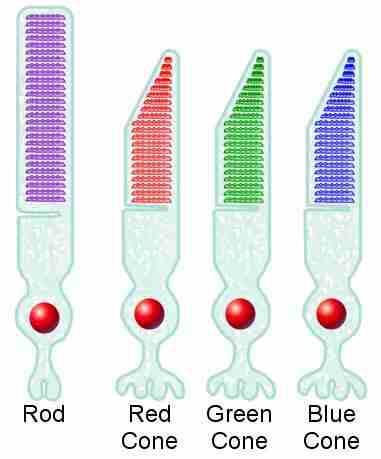
گیرندههای نوری مخروطی و استوانهای چشم :
سلولهای چشم برای آشنایی با کارکرد و نوع فعالیت چشم باید ابتدا از سادهترین ساختارهای بینایی شروع کنیم که همان گیرندههای نوری هستند. در انسان این گیرندهها به ۳ دسته تقسیم میشوند :
۱- گيرندههای مخروطی شكل ، ۲- گيرندههای استوانهای شكل ، ۳- گيرندههای مخروطی - استوانهای
گیرندههای استوانهای توانایی دید در نور کم و بنفش را میدهند.
گیرندههای مخروطی توانایی دید در نور زیاد یا همان دید رنگی را به ما و حیوانات میدهند.
گیرندههای مخروطی به سه دسته قرمز ، آبی و سبز تقسیم میشوند.
تراکم این گیرندهها در چشم ، در همه مناطق به یک میزان نیست. همانطور که در شکل پایین مشاهده میکنید در مناطق نزدیک گودی چشم - یا همان فووا - گیرندههای مخروطی به حداکثـــر میــزان خود میرسنـــد ، در حالی كه در مناطق دورتــر از فووا ، گیرندههای استوانهای بيشتر است؛ اما در قسمت نقطه کور چشم هیچ کدام از گیرندهها وجود ندارند. (ناگفته نماند که در داخل فووا میزان هر دو کاهش مییابد.)
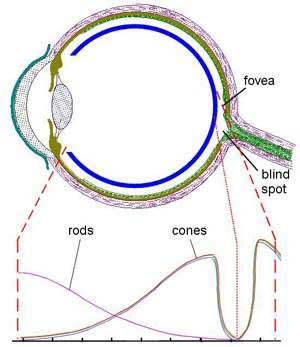
دید در سگها :
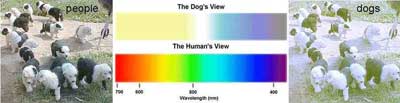
میتوان گفت كه سگها کور رنگی قرمز و سبز دارند و به نوعی تصویر را شسته شده میبینند. (اجسام از دید ما روشن تر هستند.)
سگها تیز بینی ما انسانها را ندارند؛ شاید یکی ار دلایل آن نداشتن فووا در چشم باشد. نگاه کردن سگها به صورت مستقیم به ما ، میتواند جنبه اصلاح رفتاری داشته باشد.
ديدن اجسام از ديد انسان و سگ
سگها در تاریکی دید بهتری نسبت به ما دارند ، که دلیل این امر داشتن گیرندههای استوانهای بیشتر و وجود لایه منعکس کننده Tapetum Lucidum در پشت شبکیه است.
سگها حرکت اجسام را بهتر از ما درک میکنند.
محدوده ديد انسان و سگ :
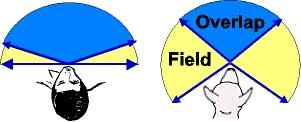
سگها محدوده دید بیشتری نسبت به ما انسانها دارند (به قسمت زرد رنگ در شکل توجه کنید). بعضی از دانشمندان معتقدند كه سگها توانایی دیدن پشت سرشان را هم دارند!
عمق دید در سگها (قسمت آبی رنگ که توسط دو چشم مشاهده میشود) کمتر از انسانها است.
تاریخ : جمعه 27 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
دریا در اینجا شکافته می شود !! + تصاویر
دو بار در سال بین فوریه و ژانویه در نزدیکی جزیره چیندو یکی از بزرگترین جزایر کره جنوبی آب به حدی فروکش میکند که جاده ای به طول حدودا 3 کیلیمتر از زیر آب ظاهر میشود. عرض این جاده طبیعی از 3 تا 10 متر متفاوت است و ساکنان جزیره میتوانند با پای پیاده از وسط دریا عبور کنند...






تاریخ : شنبه 21 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
با سلام براتون یکی از زیبا ترین فیلم ها رو براتون گذاشتم
این فیلم در باره ی رابطه ی اعداد دیبوناچی و... می باشد
حتما دانلود کنبد نظر هم بدین
اگر پس از کلیک بر روی لینک زیر اتفاقی نیفتاد می تونین اون رو کپی کرده و در
مکان آدرس مرورگرتان پیست کنین
متشکرم
http://s5.picofile.com/file/8108334484/NatureByNumbers.mp4.htm
تاریخ : پنج شنبه 19 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
زیستگاه ۱
گوزن زرد ایرانی پستانداری از خانواده گوزن است. گمان میرفت که نسل این حیوان منقرض شدهباشد تا این که در دهه ۱۹۵۰ گلهای از آن در خوزستان کشف شد. اینک گلههایی از گوزن زرد ایرانی در دشت ناز ساری در
استان مازندران در محوطه محصوری مراقبت میشوند. در برخی از باغ وحشهای جهان نیز نمونههایی از آن وجود دارد.
تاریخ : چهار شنبه 18 دی 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
تاریخ : دو شنبه 18 آذر 1392برچسب:
,
نویسنده : امیرحسین رمضانخانی
|
|
|
رابرت كُخ باكتري شناس و پزشك برجسته آلماني
رابرت كُخ باكتري شناس و پزشك برجسته آلماني در 11 دسامبر 1843م در شهر هارتْزْ آلمان به دنيا آمد. وي پس از پايان تحصيلات خود در رشته پزشكي، مطالعات و تحقيقات گستردهاي را درباره علل برخي از بيماريها همچون وبا، سل و سياه زخم آغاز كرد.
|
صفحه قبل 2 3 صفحه بعد
|